Need Help?
Ryukoku Extension Center
龍谷エクステンションセンター(REC)シーズダイジェスト

[プロフィール]
京都大学大学院農学研究科博士後期課程修了。農学博士。専門は農芸化学、医学一般、生物物理学。平成18年から23年までケンブリッジ大学で、タンパク質凝集性疾患の原因となる凝集体構造について研究。京都大学の白眉プロジェクトに参加、平成27年から現職。

照射したX線が原子の周りにある電子によって散乱、干渉した結果起こる回折現象によって、結晶構造や原子配列を決定するX線結晶構造解析という技術を使うと、非常に複雑な分子構造を持つタンパク質の姿を、3次元画像にして目で見えるようにすることができます。
タンパク質の立体構造を決定することは、生命現象の謎を解明したり、タンパク質の異常に起因する病気の原因を明らかにして治療薬の開発につなげるなど、さまざまな恩恵を私たちにもたらしてくれることになります。

X線を結晶に照射することでタンパク質の構造を可視化する
卵白のタンパク質の約60%を占めるオボアルブミンは、保存中に熱安定化し、食品としての加工特性が低下します。これまで手がけた研究の一つに、その原因を明らかにするため、卵白からオボアルブミンを取り出して、熱安定化した立体構造を解明した研究があります。
タンパク質の構造を見るためには、高純度のタンパク質を精製して、0.1~0.2ミリくらいの結晶を作り、X線回折装置を使って結晶構造を解析します。兵庫県にある大型放射光施設「SPring-8」なら、微小サイズの結晶でも高い精度の回折データを得ることができます。
分子の形を反映した電子密度図に、立体パズルのようにタンパク質を構成しているアミノ酸を当てはめていくと、原子レベルでタンパク質の立体構造を決定することができます。
卵白はpHが~10のアルカリ性であるため、その状況に置いておくと、オボアルブミンの一部を構成しているアミノ酸の化学的な配向が変わり、それが原因で熱安定性が変わるということが目に見えてわかりました。
タンパク質凝集性疾患の原因解明に取り組む
イギリスはもともと構造解析が盛んなところで、私はケンブリッジ大学で合計5年間、オボアルブミンと同じ形をしたタンパク質構造について研究しました。
と言うのも、オボアルブミンと同じ形をしたタンパク質は自然界に非常にたくさんあって(3,000種以上)、私たちの体の中にも現在わかっているだけで37種類あります。タンパク質は20個のアミノ酸がつながってできていて、アミノ酸の配列が遺伝子によって決まるわけですが、配列は異なるものの同じような形のものがたくさんあります。
その1つで、血液凝固の行き過ぎにブレーキをかけるアンチトロンビンが欠乏して起こるアンチトロンビン欠損症は、血液凝固が進行して血栓症を起こす病気です。また、アンチトリプシンは肝臓で造られる酵素で、肺の組織を守る働きがあり、欠乏すると肺気腫を、その原因となる肝臓の機能不良は時に肝硬変を発症します。
どちらも遺伝子疾患で、アンチトリプシン欠損症は日本に比べて欧米での発症率が高く、イギリスでは製薬会社でも盛んに研究が行われてきました。
アンチトリプシンは普通、肝臓で造られて血中に出ていくのに、肝臓で凝集することで肺に届かなくなって障害が起こります。アンチトリプシンの凝集体構造を明らかにすることで、それを防ぐ戦略につながるのではないかと、アンチトリプシン欠損症の原因となる凝集体構造を解明しました。
アンチトロンビン凝集体の結晶と、その結晶を元に得られた凝集体(2量体)の構造
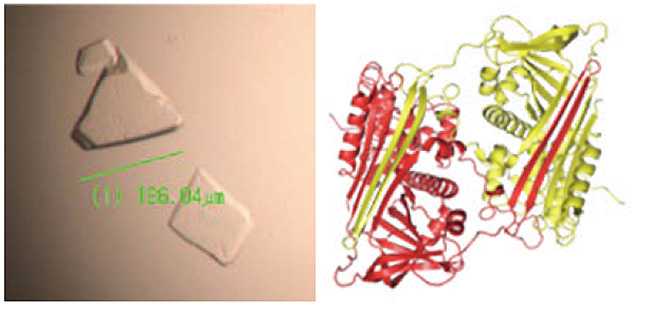
左が、私の研究者人生を大きく変えることとなったタンパク質、アンチトロンビン凝集体の結晶です。そして右が、その結晶を元に得られた凝集体(2量体)の構造です。2つの同じタンパク質が、まるでパズルのように、お互いの構造を補完して美しく連結しています。そのような概念が疾患に関わる可能性を我々は世界に先立って提唱しました。
肝臓で凝集するアンチトリプシン凝集体(3量体)の構造
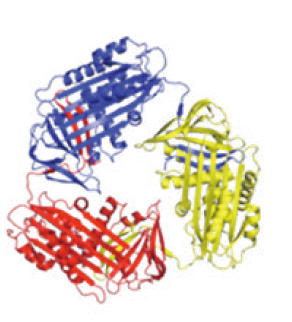
アンチトリプシン欠損症の原因となる可能性の高い、肝臓で凝集するアンチトリプシン凝集体(3量体)の構造です。この構造を元に、アンチトリプシン欠損症を治療する可能性がある薬物の設計を、ケンブリッジ大学との共同研究により行いました。
タンパク質構造から食物アレルギーへのアプローチ
イギリスでの研究は主として遺伝的原因によるタンパク質の凝集でしたが、今注目しているのは、遺伝ではなく、老化などによってタンパク質が作られる環境が悪化したことによってできえる悪いタンパク質(構造変化を起こした異常タンパク)が原因で起こる病気、例えばパーキンソン病やアルツハイマー病などです。
また、アンチトリプシン欠損症では、凝集したアンチトリプシンが肝臓に留まることが主たる原因であるという認識があったのですが、その後の細胞実験などで凝集したものも血中に出ていることがわかりました。つまり、アンチトリプシン欠損症の人は悪い凝集体が血中に出ているのです。これが健康にどのような影響を与えるのか、という視点からさらに研究を進めたいと考えています。
最近、タンパク質の構造を改変するという観点から、取り組み始めているのが食物アレルギーの問題です。食物アレルギーの原因は、主にタンパク質の構造か配列に異常が起こっているからだと考えています。
卵、小麦、蕎麦などのアレルギーの原因となるタンパク質をうまく構造変換して、アレルギーを起こさないような構造に変えることはできないかを研究するもので、これは本学農学部の山崎英恵准教授、塩尻かおり講師、岡崎史子講師、京都大学生存圏研究所の三谷友彦准教授との協同プロジェクトで進めています。
加熱によって完全に凝集するとか、特殊な性質を持った水を使うといった方法で、調理でアレルギーの原因となるタンパク質の混入を軽減したり、弱い電磁波を当てることでその構造が変えられないかといったことを調べています。また、食品のアレルギー性を下げることと、減感作療法や患者さん自身が行うセルフセラピーなどを組み合わせて、統合的に症状を軽減する方法を見出していこうとしています。
いろいろなアレルゲンとなるタンパク質があって、いろいろな患者さんのタイプがあるため、まずは実験レベルで研究して、最終的には小児アレルギーの医師との共同研究ができればと思っています。
タンパク質の構造から生命現象を見て、僕ならこういう見方ができる、どういうアプローチができるのかな?というのが基本的な研究姿勢です。
私がX線構造解析を手がけてから、この20年で技術は飛躍的に進歩しました。昔は結晶を作るのに、たいへんな苦労と手間が必要でしたが、今はロボットで一気に500種くらい結晶化をスクリーニングできます。必要なタンパク質の量も10分の1程度になり、時間も大幅に短縮され、コストも下がりました。
今、何が大切かと言うと、構造が正しく解けているかを見る目と、そこから的確な情報を取り出すための知識です。その点に関して、私にはこれまで積み重ねてきた知識や経験がありますので、これを生かして、例えば企業との共同研究などにも積極的に取り組んでいきたいと考えています。
研究者からのメッセージ
構造が見え始める瞬間の喜びが研究の支えに
見えないものが見えるようになる喜びは大きく、構造解析で一番おもしろいのは、データから構造が解け始める瞬間を見る時です。ケンブリッジ大学で私たちの研究グループが決定した凝集体の構造は、それまでの研究モデルを覆すもので、構造を解いたらまったく違うことがわかりました。世の中には大きく概念が変わる可能性がまだまだあると思います。そういう瞬間に立ち会えることは、研究者として最も心躍る時です。
構造は解いてみないとわからないし、解いてみると思いも寄らないことがあるかもしれません。想像もしなかったことが起こるのではないかという思いが、日々の原動力になっています。もちろんそれは滅多にあることではないのですが、「1000回だめでも1001回目に何かある」という気持ちで前向きに取り組みたいと考えています。